СВОЙСТВА ПОЧВЫ
ФИЗИЧЕСКИЕ СВОЙСТВА ПОЧВЫВ основном почва состоит из породы (около 45%), влаги (около 25%), органических соединений (от 0% до 5%) и воздуха (около 25%). Текстура: относительная пропорция в почве песка, глины и ила. Структура: зависит от агрегирования частиц. Плотность: показывает насколько почва "компактна". Вычисляется как масса, деленная на объем. Пористость: общий объем и структура пор в почве, т.е. пространства между ее частицами. Влияет на плотность почвы. Консистенция: выражает способность частиц почвы к слипанию, характеризует поведение почвы при механической нагрузке, зависит от количества глины в почве. Цветность: характеризует состав почвы и ее историю. Температура: нижний и верхний температурные пределы показывают микробиологическую и химическую активность почвы. ХИМИЧЕСКИЕ СВОЙСТВА ПОЧВЫКатионный обмен может происходить на коллоидных частицах глинозема или на частицах гумуса. Наиболее важными для питания растений катионами являются кальций (Ca2+), магний (Mg2+), калий (K+), менее важны ионы водорода (H+), алюминия (Al3+) и натрия (Na+). Приведем пример простой реакции обмена кальция на ионы водорода, происходящей в почвах, богатых кальцием: [коллоид]Са + 2 H+ > 2Н [коллоид] + Ca2+ В регионах с большим количеством выпадающих осадков кальций вымывается из почв, и их рН составляет обычно менее 7. В засушливых районах почвы, как правило, щелочные, с рН 7 и более. Катионообменная емкость (КОЕ) показывает, какое общее количество эквивалентов катионов может поглотить почва определенной массы. КОЕ обычно выражается в миллиэквивалентах на 100 грамм почвы (мэкв/100г). Песчаные почвы обычно имеют низкую обменную емкость. КОЕ возрастает при увеличении количества гумуса (органических веществ) и при улучшении текстуры почвы. КОЕ также сильно зависит от доли и типа глинозема, присутствующего в почве. Молодые глины типа монтмориллонита и вермикулита, как правило, имеют большую обменную емкость, нежели старые глины типа каолинитов и иллитов. Процент щелочных катионов (%BS). Коллоиды могут содержать катионы двух групп, которые отличаются влиянием на кислотность почвы. К первой группе относятся ионы водорода и алюминия (H+, Al3+), которые поставляют ионы водорода в раствор. Ко второй группе относятся все другие катионы: кальций, магний, натрий и калий (Ca2+, Mg2+, Na+, and K+). Они являются щелочными катионами и нейтрализуют кислотность. Доля полной катионообменной емкости, которая приходится на катионы щелочных и щелочноземельных металлов (кальция, магния, натрия, калия), выражается величиной «процент щелочных катионов» (%BS). Увеличение pH почвы соответствует повышению процента щелочных катионов. Почвы со значительным содержанием гумуса являются более кислыми, поскольку хуже связывают кальций. Процент щелочных катионов в таких почвах может быть ниже 66%. В такие почвы необходимо вносить известь для повышения процента кальция и увеличения рН. Почвы в засушливых регионах имеют рН около 7 и процент щелочных катионов близкий к 100%. Реакция почвы (рН), мера ее кислотности (нейтральности, щелочности) - одна из важнейших характеристик почвы, влияющих на ее плодородность. Регулирование рН до оптимальной величины приводит к значительному росту экономической эффективности земледелия. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
АНАЛИЗ ПОЧВ И РАСПОЗНАВАНИЕ ТИПОВ ПОЧВ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Проведение диагностики позволяет своевременно выявлять специфические проблемы, связанные с почвой, как то: неоптимальное рН, недостаток или избыток солей, плохая текстура и т.д.
Оценка плодородности – это анализ почвы на предмет содержания и соотношения в ней существенно важных питательных веществ для определения, какие удобрения могут быть рекомендованы для данной почвы. Методы диагностики позволяют классифицировать почвы, относя их к одной или нескольким из нижеследующих типов: Кислые почвы обладают pH меньше 7.0. Такие почвы быстро теряют продуктивность в связи с низким содержанием питательных веществ и наличием токсичных ионов, например алюминия. Щелочные почвы обладают pH выше 7.5, их можно разделить на известняковые и засоленные. Известняковые почвы содержат большие количества свободного известняка (CaCO3). Обычный уровень pH в таких почвах составляет от 7.5 до 8.5. Засоленные почвы содержат большие концентрации растворимых солей, в том числе в форме способного к обмену натрия (натриевые почвы). Песчаные почвы подразделяются на сплошные песчаные и суглинки. Они подвержены ветровой эрозии, засухе и обладают низкой плодородностью. Глинистые почвы обладают плотной текстурой, поскольку состоят из мелких фракций. Для таких почв характерны проблемы дренирования, повышенного содержания влаги и аэрации. При анализе плодородности оценивают катионобменную ёмкость почвы, кислотно-щелочной баланс (pH) и долю растворимых питательных веществ органической и минеральной природы для установления следующих факторов: 1) Способность почвы удерживать те или иные составляющие удобрений; 2) Соотношение питательных веществ в почве; 3) Процентное содержание органических веществ; 4) Способность поставлять необходимые количества природных питательных веществ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ПРОБЛЕМЫ ПОЧВ, ВОССТАНОВЛЕНИЕ ПЛОДОРОДИЯ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Известняковые почвы имеют pH в диапазоне от 7.5 до 8.4. Высокая щёлочность оказывает своё влияние на растворимость или доступность определённых питательных веществ. Примером могут послужить доступный фосфор (в форме двузамещенного ортофосфата, HPO42–), который переходит в менее растворимую, и, следовательно, менее доступную форму при pH, превышающем 7.5. Это приводит к уменьшению эффективности фосфорных удобрений. Доступность микроэлементов-металлов (железа, цинка, меди и марганца), а также бора уменьшается вследствие увеличения щелочности.
Известняковые почвы достаточно часто могут быть отнесены к засоленным, хотя это верно не во всех случаях. Поскольку CaCO3 имеет достаточно низкую растворимость, некоторые почвы могут содержать до 30% известняка и, тем не менее, не быть засоленными. Известняковые почвы достаточно легко идентифицировать: при действии 2.5 н соляной кислоты они «тают», уменьшаются в объеме.
Засоленные почвы не поддаются коррекции химическим путем, используется только дренирование. Состав засоленных/натриевых и натриевых почв можно корректировать путем внесения извести и дренированием. В случае натриевых почв, содержащих также некоторое количество свободной извести, в почву для улучшения ее качества можно вносить серу.
*Единица проводимости, миллиСименс на сантиметр. **S AR (Sodium Adsorption Ratio) – доля адсорбированного натрия относительно кальция и магния. В верхнейтаблице даны значения для почвенных растворов (saturated paste extracts, ECe). Как правило же, экспериментальные величины определяются для суспензий почвы, для приготовления которых почвы и вода берутся в соотношении 1:1. В таблице ниже приведены степени солености (в мСм/см) для почв четырех различных текстур; данные получены для суспензий 1:1.
Кислые почвы характерны для регионов с повышенной влажностью. Частые дожди приводят к вымыванию из почвы извести, а также солей других щелочных металлов. Кроме того, кислотность усиливают большинство применяемых удобрений, а также ионы водорода, которые выделяются растениями. Для остановки этого процесса необходимо своевременно и в необходимых количествах вносить в почву известь. Требуемое количество извести, достаточное для приведения рН к необходимому уровню, можно рассчитать, имея результаты измерения буферной емкости почвы ("SMP buffer"). Почвы с проблемными текстурами Почвы состоят из частиц, которые различаются размером и формой. Соответственно, согласно размеру частицы можно разделить на различные фракции. Почва, как правило, состоит из частиц различных фракций: от мелких частиц глины до крупных частиц песка. Суглинки состоят из частиц песка, глины и ила. Для определения текстуры почвы применяется метод«вручную». | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ПИТАНИЕ РАСТЕНИЙ, УДОБРЕНИЯ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Основными факторами, влияющими на питание растений, являются:
1) Количество питательных веществ в почве. 2) Способность почвы поставлять питательные вещества растениям.Когда рН почвы выше 7, множество микроэлементов, таких как железо, кобальт, цинк, становятся для растений недоступными, так как переходят в форму нерастворимых солей. С другой стороны, при рН 6 они вполне доступны. 3) Климатические факторы.Холодная и дождливая погода ухудшает питание растений. ОСНОВНЫЕ ПИТАТЕЛЬНЫЕ ЭЛЕМЕНТЫШестнадцать химических элементов считаются основными для питания растений. Без них растения погибают. Основные питательные элементы подразделяются на следующие группы: 1)Главные неминеральные макроэлементы. Они составляют 90-95% сухой массы растений, и поставляются из воды и воздуха: Углерод- C Водород- H Кислород- O 2) Первичные макроэлементы Эти питательные элементы поглощаются растениями из почвы. Основные проблемы питания растений происходят в основном из-за недостатка именно этих элементов: Азот- N Фосфор- P Калий- K 4) Вторичные макроэлементы Также поглощаются растениями в значительном количестве, однако их недостаток реже приводит к возникновению проблем с питанием растений Кальций- Ca Магний- Mg Сера- S 4) Микроэлементы Как правило, растениям требуются лишь следовые количества этих элементов Бор- B Хлор- Cl Медь- Cu Железо- Fe Марганец- Mn Молибден- Mo Цинк- Zn | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
АЗОТ В ПОЧВЕ, СОДЕРЖАНИЕ АЗОТА | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Азот является незаменимым элементом для синтеза белков и нуклеиновых кислот. Без достаточного поступления азота растения быстро погибают. Многие почвы испытывают дефицит азота. Чтобы компенсировать недостаток азота, в почву вносят азотные удобрения. Азот поглощается растениями в виде двух форм, аммонийной (NH4+) и нитратной (NO3–). Натуральными источниками аммонийного азота являются компост и навоз, т.е. ионы аммония образуются при разложении органических соединений. Нитраты являются конечной формой разложения органических веществ.
Одним из основных продуктов разложения является газ аммиак, NH3. Этот газ чрезвычайно хорошо растворим в воде, с которой реагирует с образованием иона аммония (NH4+). Растения поглощают аммоний, и используют содержащийся в нем азот для синтеза питательных веществ. Этот процесс составляет короткий круг цикла азота. Две группы нитрифицирующих бактерий переводят аммиак в другие формы, а именно – одна группа бактерий превращает его в нитрит-ионы (NO2-), а другая превращает нитрит-ионы в нитрат-ионы (NO3-). Нитраты являются для растений основным уточником азота. Описанный процесс составляет второй круг в цикле азота. Нитрифицирующие бактерии переводят аммиак в нитриты и нитраты только в том случае, если в почве содержится достаточно кислорода (аэробные условия). При недостатке кислорода происходит обратный процесс – денитрифицирующие бактерии переводят нитраты и нитриты в азот, инертный газ. Большая часть газообразного азота недоступна для растений, газ в основном уходит в атмосферу. Однако, небольшая его часть возвращается обратно в почву по двум путям: 1) Во время гроз под действием атмосферного электричества азот переводится в нитраты и другие соединения, которые попадают в почву вместе с осадками. 2) Благодаря действию группы бактерий, связывающих газообразный азот в более сложные органические вещества в почве. Описанный процесс составляет третий круг в цикле азота. ПЕРЕВОД ЕДИНИЦ ИЗМЕРЕНИЯ ПРИ АНАЛИЗЕ НИТРАТНОГО АЗОТА При переводах единиц из одних в другие, как правило, происходит множество досадных ошибок. Поэтому, на этом вопросе следует остановиться отдельно. Путаница происходит при пересчете: 1) нитратов в нитратный азот и наоборот 2) миллиграммы на литр (мг/л, ppm) в массовые проценты азота (%) и наоборот 3) ppm в фунты на акр (а также килограмм на гектар, кг/га) и наоборот. В следующей таблице перечислены наиболее употребляемые коэффициенты пересчета между такими формами азота, как нитратный азот, нитрат-ион и нитрат калия. Коэффициенты рассчитаны, исходя их молекулярных весов этих форм.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| pH ПОЧВЫ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
pH ПОЧВЫ, ИЗМЕРЕНИЕ рН В ПОЧВЕЗначение pH отражает кислотно-щелочной баланс, отношение «кислотных» ионов водорода (H+) к «основным» гидроксид-ионам (OH–). Водные среды, в которых преобладают ионы водорода, называются кислыми, а те, в которых преобладают гидроксид-ионы, называются щелочными (или основными). Равные количества ионов водорода и гидроксид-ионов отвечают условиям нейтральных сред. Шкала pH является мерой концентрации ионов водорода в водном растворе. При pH 7 раствор нейтральный, при рН более 7 – щелочной, при рН меньше 7 – кислый. Каждая единица шкалы, от 0 до 14, выражает 10-кратное измерение концентрации ионов водорода. Так, отношение кислота/основание для среды с рН 6 равно 10:1, для среды с рН 7 – 1:1, для среды с рН 8 – 1:10. Так как рН 4 отличается от рН 7 на три единицы, то среда с рН 4 является в 103 = 1000 раз более кислой, чем среда с рН 7, и в 10000 раз более кислой, чем среда с рН 8. pH некоторых типов образцов 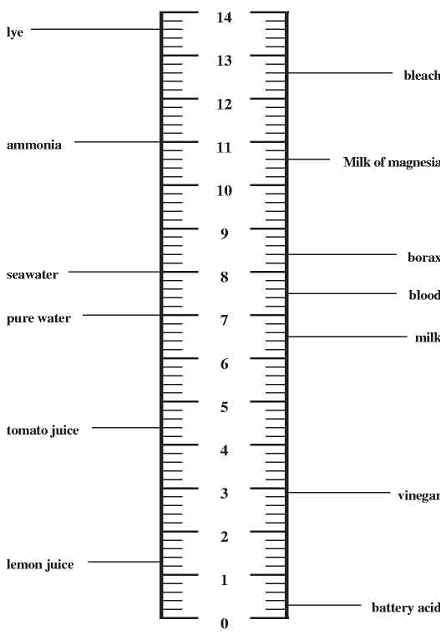
ПОЧЕМУ рН ЯВЛЯЕТСЯ ПАРАМЕТРОМ, КОТОРЫЙ ВАЖНО КОНТРОЛИРОВАТЬ? pH является важным параметром, поскольку он влияет на: 1) доступность питательных веществ, макро- и микро-элементов 2) растворимость токсичных веществ 3) микробиологическую активность почвы 4) развитие и функционирование клеток корней растений 5) катионнообменную емкость почв, которые содержат глину и гумус – материалы, обменная емкость которых зависит от рН. Ранний мониторинг рН необходим для правильной обработки почвы. Тенденции изменения рН особенно важно отслеживать в случаях кислых почв и почв песчаных. В приведенной ниже таблице перечисляются некоторые характеристики почв с различным уровнем рН. рН ПОЧВЫ И ЕГО ВЛИЯНИЕ НА УСЛОВИЯ РОСТА РАСТЕНИЙ Диапазон рН 6.5-7.0 является оптимальных для выращивания большинства культур. Когда рН выходит за эти рамки, можно ожидать появления каких-либо проблем.
КИСЛОТНОСТЬ ПОЧВ Почвы становятся кислыми по нескольким причинам. В нормальных условиях известь выступает в роли буфера, нейтрализуя избыточную кислоту, попадающую в почву из дождей, минеральных удобрений, а также образующуюся в результате жизнедеятельности растений и разложения органических веществ. Когда известь заканчивается, сдерживающий уменьшение рН фактор исчезает, и кислотность почвы может начать резко расти. В результате, в почве появляется значительная доля свободных ионов водорода (H+) и алюминия (Al3+). Такие условия непригодны для нормального роста растений. Добавление извести возвращает почве буферную емкость, а также приводит к стабилизации рН в оптимальном для роста растений диапазоне. При оптимальном рН растворенный токсичный алюминий переводится обратно в нерастворимую форму. ЩЕЛОЧНЫЕ ПОЧВЫ В засушливых и полузасушливых регионах природного содержания известняка в почве обычно достаточно для поддержания условий 100% доли щелочных катионов (%BS) Известняковые почвы содержат частицы чистого карбоната кальция и/или магния. рН таких почв, как правило, выше 7.5. При действии на них 10%-ной соляной кислотой можно визуально наблюдать выделение углекислого газа. Для уменьшения рН известняковых почв иногда в них вносят серу, но эта мера не может считаться выгодной экономически – для нейтрализации почвы средней текстуры с содержанием всего 2% извести требуется внести много тонн элементной серы на акр или гектар. Лучшим способом уменьшить рН является применение минеральных удобрений, имеющих кислую реакцию. Для восполнения недостатка микроэлементов в щелочных почвах в них можно вносить хелатные комплексы металлов. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ИРРИГАЦИОННЫЕ (ПОЛИВОЧНЫЕ) ВОДЫ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| КАЧЕСТВО ОРОСИТЕЛЬЫХ (ПОЛИВОЧНЫХ) ВОД
Существуют четыре основных критерия, по которым проводится оценка качества оросительных (ирригационных) вод: 1) концентрация растворимых солей 2) концентрация катионов натрия относительно концентрации других катионов 3) концентрация токсичных элементов, которые могут негативно влиять на рост растений, а также представлять опасность для окружающей среды 4) концентрация питательных элементов (ирригационные воды могут содержать нитраты, фосфаты в значительных количествах). С помощью тестового набора фирмы «HACH» можно провести определения в ирригационных водах общей растворимой соли, натрия, натратов и фосфатов. ОПАСНОСТЬ ВЫСОКОЙ КОНЦЕНТРАЦИИ СОЛЕЙ Основными неорганическими катионами, присутствующими в ирригационных водах, являются кальций (Ca2+), магний (Mg2+) и натрий (Na+). Основными анионами являются хлориды (Cl-), сульфаты (SO42–) и бикарбонаты (HCO3–). Могут присутствовать и другие ионы, однако, как правило, они не имеют значительного вклада в соленость. Определение уровня солености проводится путем измерения электропроводности (EC), которая выражает в микроСименсах на сантиметр (µS/cm). В случаях, когда уровень солености ирригационных вод достаточно высок, очень важно хорошо дренировать почву, а также промывать почву избытком ирригационной воды. ОПАСНОСТЬ ВЫСОКОГО СОДЕРЖАНИЯ НАТРИЯ Применение ирригационных вод, содержащих высокие концентрации натрия относительно концентраций кальция (Ca) и/или магния (Mg), может привести к увеличению доли свободного, способного к обмену натрия в почве. Это, в свою очередь, приводит к увеличению рН почвы до 8.5 и выше, т.е. почва становится натриевой. Коллоидные частицы почвы растворяются, в результате чего в дальнейшем формируется непрерывная протяженная физическая структура, чрезвычайно затрудняющая перколяцию и инфильтрацию воды. Почва становится очень плотной, и и в набухшем состоянии практически не пропускает воду. Чем больше глинозема содержалось в исходной почве, тем хуже влага фильтруется через такую почву, когда она становится натриевой. Величина негативного влияния натрия оценивается по величине S AR (доли натрия относительно кальция и магния) относительно общей солености (ECiw). Формула, по которой проводится определение SAR, выглядит следующим образом: 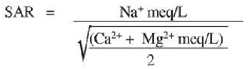
Пример: Предположим, что концентрация натрия в ирригационной воде составляет 10 мэкв/л, а кальция и магния в сумме (общая жесткость) 5 мэкв/л. Согласно формуле, SAR равен: 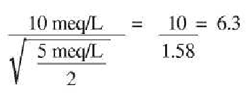
НОМОГРАММА ДЛЯ ОПРЕДЕЛЕНИЯ SAR ИРРИГАЦИОННЫХ ВОД 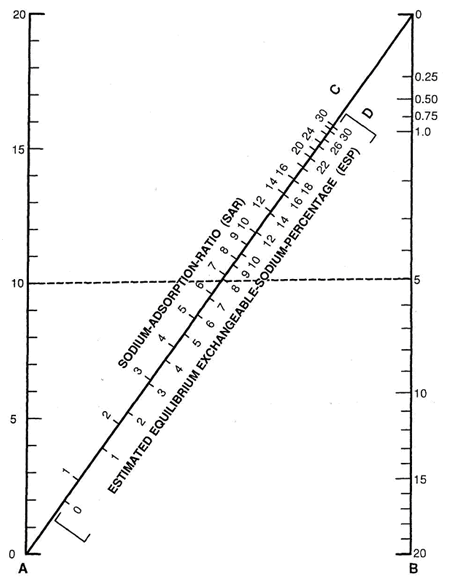
ТОКСИЧНЫЕ ЭЛЕМЕНТЫ Некоторые элементы являются токсичными для растений. Однако, для каждого вида растений токсичными могут быть различные соединения, так что понятие «токсичности», вообще говоря, зависит от выращиваемой культуры. Элементы, которые могут быть токсичными: бор, натрий и тяжелые металлы (мышьяк, кобальт, медь, свинец, никель и цинк). ПРИСУТСТВИЕ ПИТАТЕЛЬНЫХ ЭЛЕМЕНТОВ Высокий уровень нитратов и фосфатов в ирригационных водах представляет собой экологическую опасность, однако, с другой стороны, эти анионы поставляют в почву дополнительные количества азота и фосфора. Ирригационные воды, содержащие 10 ppm (10 мг/л) нитратного азота, поставляют 30 кг азота на каждый объем воды с площадь гектар и высотой 30 см. ПРИМЕНЕНИЕ СОЛЕНЫХ ИРРИГАЦИОННЫХ ВОД При применении для ирригации соленой воды требуются повышенные ее количества, чтобы вымывать из почвы соли, оставшиеся после предыдущей ирригации. Если невозможно достичь требуемого избытка ирригационной воды, необходимо либо выращивать культуру, более устойчивую к засолению, либо мириться с неизбежным уменьшением урожайности. МЕТОДЫ ОБЫЧНОЙ И ЧАСТОЙ ИРРИГАЦИИ Для ирригации может применяться метод обычной и частой ирригации. В последнем случае почва постоянно остается влажной, и доступность воды для растений – неизменно высокой. В обычном методе ирригации почва упевает высохнуть между двумя ирригациями. При этом растения испытывают шок, связанный с пониженной доступностью влаги в тот период, когда почва остается сухой. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||




















